A ver, intentaré resolverte las dudas como bien pueda por este medio ;)
1.- El 02 puede formar enlaces entre los átomos de oxigeno pero también servir como puente, pues tiene 2 electrones que pueden compartir, como si fuera -O-O- donde los extremos se unirían a otros átomos. Un ejemplo es el ozono (O3) que tendría una forma cíclica de triángulo en plan O-O-O (unidos en triángulo los tres). Obviamente también forma la molécula biatómica con doble enlace de O2.
El CO puede formar el CO (:C=O) y el CO2 (O=C=O) . También podría formar enlaces de la siguiente forma -O-C=O en donde el último electrón que le falta al C (porque tiene 4 para 4 enlaces) puede unirse a otro átomo.
El Al2O3 (alúmina u óxido de aluminio) en verdad es una unión de O=Al-O-Al=O, es estable debido a los enlaces dobles de los extremos.
El SO3 tendría forma triangular donde los oxígenos (con dos cargas) compensan las 6 cargas del ES en esta configuración en forma de estrella. O=^S=O y otro oxigeno irá con doble enlace encima del S para tener los 3 oxígenos. El SO2 será sin ese tercero, de esta forma O=S=O
2.- Los átomos de electronegatividad parecida tienden a compartir los electrones por varias razones. Una de ella es porque ambos átomos "tiran" o atraen a los electrones con la misma intención, la afinidad o la fuerza hace que no haya candidato favorito, aunque mientras no sean el mismo átomo, algo de atracción tendrá uno un poquito más que el otro. Otra razón es la carga que tienen, en el que el electrón "flota" entre ambos para que sea compartido. La idea que debes tener es que se comparte el electrón como si así la estabilidad se potenciara sin crear tensiones, que es la dirección a la que tienden a ir los elementos.
3.- Este ejercicio no lo puedo hacer aquí, pero te explico un poco la nomenclatura de Lewis (leído "Luis" y no "leguis"). Mira esta página para completar la información:
http://pe.kalipedia.com/popup/popupWindow.html?anchor=klpprcryc&tipo=imprimir&titulo=Imprimir%20Art%EDculo&xref=20070924klpcnafyq_79.KesY también esta
http://atomos02.wikispaces.com/file/view/lewis.gif/96904948/lewis.gifK+: Tendrá 1 electrón en la última capa, pero con una carga positiva, con lo cual tendrá su configuración con una carga positiva solamente, un puntito blanco.
O2-:tendrá 2 electrones en su última capa de más, es decir, tendrá 8 puntitos negros, con 2 electrones para compartir.
S2-:tendrá 2 electrones más en su última capa, igual que antes.
Al3+: tendrá 3 huecos más de su configuración, con lo cual sólo tiene 3 puntos blancos
I1-: tendrá 8 puntitos negros, pues es una carga más que la que tiene original.
N3-: tendrá también 8 puntitos negros, pues son 3 electrones más de los originales 5.
4.- Este ejercicio es como el anterior pero simplemente fijándote en el grupo de cada uno, que será igual al número de cargas y las unes con el otro elemento. Tienes que saber las cargas que tienen cada una. No puedo resolverlo porque sería complicado representarlo por aquí, pero es sencillo, ya te digo, como el anterior, suponiendo cargas y uniéndolas. Mirate las páginas que te he enviado para ver ejemplos.
5.- KBr --> K(+) Br(-)
CaCl2 --> Ca(+2) 2Cl(-)
GaF3 --> Ga(+3) 3F(-)
FeS --> Fe(+2) S(-2)
K2O --> 2K(+) O(-2)
LiBr --> Li(+) Br(-)
Ca3P2 --> 3Ca(+2) 2P(-3)
6.- Se denomina enlace covalente coordinado o dativo al enlace químico que se forma cuando dos cuerpos comparten un par de electrones, procediendo estos dos electrones de uno de los dos átomos. Es también el responsable de ciertos iones como el ion amonio (PH4+), donde el fósforo cede los dos electrones para que el cuarto hidrógeno (que previamente se habría ionizado) se una a él, de tal manera que los enlaces de los cuatro hidrógenos son iguales.
7.-La regla es del "octeto" no del "opteto". ;)
La regla nos dice que todo elemento tenderá a tener la configuración electrónica del gas noble para estar estable, por eso, para conseguirla necesita 8 electrones en su última capa. Esto nos dice la regla, pero hay excepciones en donde, pese a no tener esa configuración en átomos o moléculas, son igualmente estables. Esta regla simplemente nos sirve para predecir el enlace y las características que tendrá el compuesto.
8.-Los electrones de valencia serán los que actúen en las reacciones y en las uniones. Son los electrones más externos y por ende, más fácilmente extraíbles del átomos, por eso son los que reaccionarán. Es como si quieres coger de un cubo caramelos, los más fáciles serán los de arriba, pues para coger el de abajo del todo necesitarías más trabajo.
Entonces, esos electrones más alejados pero no sueltos, serán los que por medio de uniones a otros átomos con otros electrones formen diferentes tipos de enlaces según el otro átomo y su electronegatividad, como comentamos al inicio.
9.- La formación del agua será por medio de dos átomos de H(+) con uno de O(-2) formando la molécula por medio de enlaces convalentes H-O-H. El ángulo entre ambos H será de 104.5º, donde en la parte posterior se alojan los electrones libres del O que no han reaccionado con los H, porque como dijimos al inicio, el O tiene 6 electrones en su última capa. La figura sería algo como esto:
http://www.carisgamba.com/CTmoleculas/agua2%255B1%255D.gif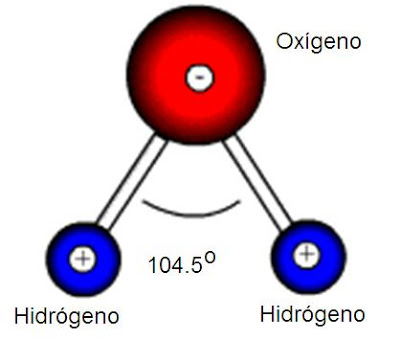
El NH· significa que tiene un electrón libre (no una carga negativa). Es la molécula N-H normal pero con un electrón libre con el que se puede unir a otra parte de molécula diferente, por medio de enlaces como hemos visto antes. El ángulo será de 180º en principio, siempre dependerá de la molécula que se una por el otro lado del N.
El HF es una molécula lineal también, pero donde el H se une al F y por la otra parte del F se colocan los otros 6 electrones libres unidos en pares, con lo cual tendríamos 3 orbitales de electrones con 3 electrones cada uno en forma de prisma triangular y por la otra parte del F tendremos el enlace iónico con el H. Mira la siguiente imagen:
http://qorganica.perruchos.com/sites/default/files/images/electronegatividad.gif10.- La transferencia se produce para mantener el equilibrio eléctrico o electroestático. La forma de hacerse es por medio de un donante que necesita o prefiere deshacerse de un electrón para estar más estable que sería capatado por un receptor que necesita o prefiere captar electrones para estar más estable. Es una "simbiosis" electrónica. Es como el vacío y el aire, si una parte tiene vacío estará más estable si entra aire y se relajara la presión, al igual que si hay mucho aire a presión, tenderá a liberarse al medio para estar más estable.
Espero haberte ayudado en tus dudas! Si tienes más consúltamelas que las resolveré encantado!

