Jajaja!
Hola
(xxxxxx):
Para nada me molestas! Si lo que quiero es que me preguntes que estoy aquí para resolverte dudas, ademas, me satisface saber que te van sirviendo mis respuestas!
Intentaremos explicar estas cuestiones:
1.- La polaridad de una molécula se basa en las cargas o electronegatividades de las partes, es decir, como vemos en la molécula BaCl2, el Ba y el Cl tienen electronegatividades muy diferentes, por eso generaría polaridad. Definiendo entonces polaridad como la "concentración" de carga negativa en una de las partes de la molécula, creando así una diferencia de potencial, una polaridad.
La molécula BaCl2 no es polar, pero si tiene polaridad, sólo que se compensa la de un Cl con la del otro Cl de este modo --> Cl-Ba-Cl
Mientras que la molécula BaCl, al ser sólo un Cl, no puede compensarse con el otro y los electrones libres del Cl generarían una polaridad negativa hacia el otro extremo, tal que:
Ba-Cl (hacia el lado del Cl opuesto al Ba están todos los electrones libres del Cl pues le sobran 6 aún, como vimos anteriormente, pues tiene 7 electrones libres).
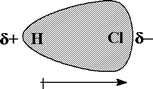
Esta imagen te enseña el concepto de polaridad y la generación de concentración de carga negativa por un elemento muy electronegativo, el ejemplo es el del HCl
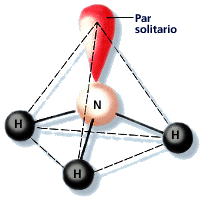
Otro ejemplo de molécula polar, que es el amoniaco NH3, con su par solitario de electrones arriba, pues el N tiene 5:
Otro más del agua, el Oxigeno tiene 6, con lo cual 2 electrones van a cada H y 4, divididos en pares de dos, se van a la parte contraria de los enlaces, generando así la polaridad:
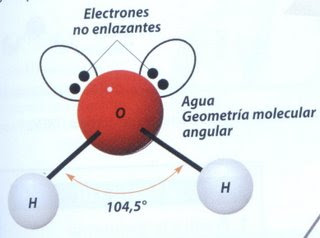
Para que te hagas una idea, una molécula polar es como un imán, por una parte donde están los electrones hay mucha carga negativa y se acercaran los elementos positivos. Por la otra parte hay mucha carga positiva y será donde se acerquen otras moléculas más negativas.
Con lo cual, el Cl, al tener 7 electrones, uno lo gasta con uno del Ba y le sobran 6, que se reparten en tres pares que se alojan en la parte contraria al enlace y eso pasa con el otro Cl, por eso no hay parte dominante negativa, porque ambos lados se compensan con sus electrones libres, mientras que el BaCl sólo tiene una parte con electrones libres del Cl que distorsionaría la nube de carga negativa atrayéndola hacia la parte de los electrones libres del Cl.
2.- Siempre serán mayormente energéticos los enlaces iónicos frente a los covalentes. La razón es muy simple y te la voy a explicar de dos formas.
Una de las razones, más lógica y visual. El enlace iónico se basa en la deficiencia de electrones y la abundancia de ellos por la otra parte, pues es una CESIÓN o ENTREGA de electrones de uno que tiene muchos a otro que necesita para alcanzar mayor equilibrio. Un ejemplo es como el del coche que te dije anteriormente; si un hombre necesita dinero que tiene un coche que no usa y conoce a otro que necesita un coche y ademas tiene dinero para pagarlo, el negocio entre ellos es inminente y será muy fácil hacerlo. En química esto significa que en el enlace iónico uno de los átomos tiene un electrón o varios y se encuentra con otro que necesita uno o varios, ambos para estar más estables, con lo cual la unión será muy fácil y rápida. Se da entre elementos de muy diferente electronegatividad, como puede ser el HF, NaCl, CaO...
Mientras que el enlace covalente es una COMPARTICIÓN de electrones. La necesidad de tenerlo no es tan fuerte porque ambos tienen un número bueno de electronesy simplemente que para unirse se combinan y comparten un electrón. Es como si dos personas tienen ambos coches y un día van con el del uno y otro día van con el del otro, no hay necesidad pero se complementan mejor. La unión es más abierta y no tan necesaria. Se da entre elementos de parecida electronegatividad, como pueden ser las moléculas del O2, N2, SO2...
Y te preguntarás, ¿por qué entonces es más energética la iónica que la covalente? Pues porque la estabilidad que adquieren los átomos, o más bien, la molécula es mayor al haber esa necesidad y romperla será más difícil. Imagina que una empresa quiere tener un buen negocio, será más complicado hacerlo si es un negocio de millones que de unos euros.
3.-El que MENOR energía tendrá será el NaH, pues es un enlace de elementos con una diferencia de electronegatividad menor.
El siguiente con mucha mayor energía será el NaCl, pues ya son elementos con más diferentes electronegatividades.
El siguiente con más energía será el NaF
Y el que tiene mayor energía será el HCl
Esto es así debido a dos conceptos. Un mayor poder positivo de las cargas del catión y un menor tamaño de éste. Cuanto mayor sea la carga concentrada en un menor tamaño de átomo, más cerca estarán del núcleo los átomos que se acerquen a él y así más fácilmente los atraerá. Es tan sencillo como entender que será más fácil agarrar a una persona que está a tu lado que a uno que está a 2 metros.
Tienes que saber que a medida que subes en la tabla periódica el volumen del átomo disminuye, pues las capas de electrones serán menores.
4.-Na(+), K(+), Sr(2+), Mg(2+), V(5+,4+,3+,2+), Cr(2+,3+,4+,5+,6+), Ni(2+,3+), Au(1+,3+), C (2+,4+,4-), P(3+,4+,5+,3-), Se(2+), N(+,2+,3+,4+,5+,3-), O(2-), Cl(1+,3+,5+,7+,1-), Bi(3+,5+)
5.- Te pongo el número de oxidación de cada elemento, tú ya sólo tienes que sumarle a las cargas el número de átomos que tiene de cada elemento ;) Lo que tienes que ver en este ejercicio es que se compensen las cargas positivas con las negativas. Te hago el primer ejemplo y el resto lo haces tu:
H2TeO4 --> H(+) Te(+6) O(-2) Tenemos 2 átomos de H con carga(+), así que por ese lado tendremos (2+). Luego está el Te que actuaría con (+6) y se le suma las (2+) anteriores y nos darán (+8). Esto se tiene que compensar con algo negativo, que lo aporta el oxigeno que tiene (-2) cada átomo y como tiene 4 átomos, nos darán (8-). Con lo cual está compensado!
Los siguiente se hacen de la misma forma, los resultados serán estos:
Cu2SO4 --> Cu(+) S(+6) O(-2)
CrO3 --> Cr(+6) O(-2)
I2 --> I(+) I(-)
B2O3 --> B(3+) O(-2)
HVO3 --> H(+) V(+5) O(-2)
HBiO3 --> H(+) Bi(+5) O(-2)
H2CO3 --> H(+) C(+4) O(-2)
Espero haberte ayudado de nuevo! No dudes, si tienes más problemas coméntamelos que mi función aquí es ayudar en cuanto pueda, no es ningún esfuerzo, es más, me gusta resolver dudas.
Así que si tienes más, no dudes en mandarlas.



