¿Cómo hacer un diagrama PV, termodinámica?
En un diagrama PV trace las trayectorias para cada uno de los siguientes procesos que ocurren en forma sucesiva en un sistema cerrado consistente en 2 moles de aire a condiciones estándar de presión y temperatura.
Proceso 1: isobárico hasta duplicar la temperatura inicial
Proceso 2: isotérmico hasta triplicar el volumen del estado inicial
Proceso 3: isocórico hasta reducir la temperatura al valor del estado inicial
Proceso 4: isotérmico hasta reducir el volumen al valor inicial.
1 Respuesta
Respuesta de albert buscapolos Ing°
2
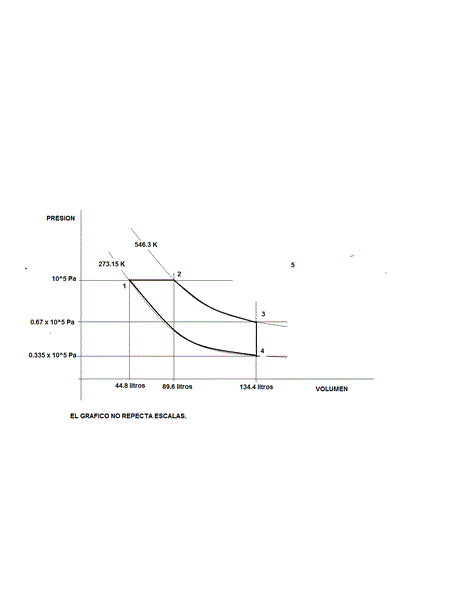

Ahora solo falta aclararle que eso es el diagrama de un motor ciclo diesel.! - Boris Berkov
Exactamente Boris. (Uffff. Yo me lo había olvidado)... - albert buscapolos Ing°
Seria bueno que eso se lo explicase el profesor en clases, para que no crean que estan haciendo un simple ejercicio sin sentido, sino que es algo real que esta en la calle todos los dias! - Boris Berkov
Es verdad......................... - albert buscapolos Ing°
Igualmente parece que Marcela no clasifica las respuestas............................... - albert buscapolos Ing°
quise decir" no califica" las respuestas. - albert buscapolos Ing°
Es cierto... y lamentable. Tomarse el trabajo de hacerle el diagrama, un tema interesante que es que "nos salio un motor diesel".. y ni siquiera califica. Dejo mi voto en compensación. - Boris Berkov