Lo que estamos midiendo con el pH es la cantidad de protones (H+) que hay en la disolución acuosa. Pero, ojo, tal y como está definido, como tiene un signo negativo en su fórmula, da como resultado que cuanto menor sea su valor, mayor será la presencia de protones en el medio. Recordemos que precisamente, los ácidos hacen aumentar esta concentración, así que un valor bajo de pH indica una acidez alta.
Y al revés, las bases hacen disminuir esta concentración (bien aumentando la presencia de hidroxilos (OH–) o disminuyendo los protones (H+). Así que un valor alto de pH indica una alta basicidad. Un poco mareante, lo sé. Pero aunque parezca que los químicos lo han hecho para fastidiar, toda esta manera de hacer las cosas tiene su razón de ser, de verdad.
Ya sólo nos queda terminar de explicar lo que es el pH neutro, que está entre los ácidos y las bases. Sería ese pH que tiene el agua pura, cuando la concentración de hidroxilos es igual que la de protones. Una sustancia que tiene ese pH se dice que es una sustancia neutra. Y este valor (podríamos demostrarlo pero para no liar mucho más esto, me vais a creer) es 7.
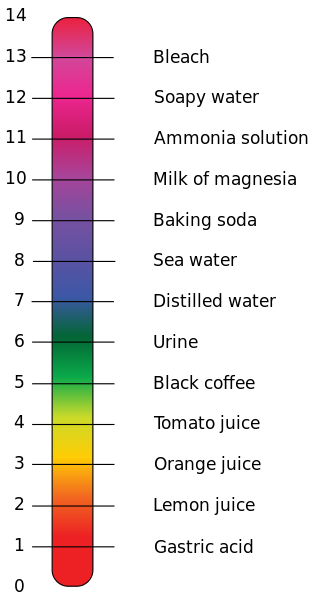
Con lo cual ya tenemos nuestro baremo: las sustancias con un pH menor que 7 son ácidas (cuanto más bajo este valor, más fuerte será el ácido); las sustancias con un pH mayor que 7 son básicas (cuanto más alto sea este valor, más fuerte será la base); y las sustancias con un pH igual a 7 son neutras. La escala normalmente va de 0 a 14, como se ve en la imagen anterior.
 Ojo con esto del pH neutro, cuando un producto cosmético anuncia en la televisión que tiene pH neutro, no quiere decir pH 7, sino que tiene el mismo pH que la piel, que es de 5,5. Como veis, la piel es ligeramente ácida. Lo ideal es que el jabón que utilicemos tenga el mismo pH que la piel (cuanto más próximo a 5,5 sea su pH, mejor).
Ojo con esto del pH neutro, cuando un producto cosmético anuncia en la televisión que tiene pH neutro, no quiere decir pH 7, sino que tiene el mismo pH que la piel, que es de 5,5. Como veis, la piel es ligeramente ácida. Lo ideal es que el jabón que utilicemos tenga el mismo pH que la piel (cuanto más próximo a 5,5 sea su pH, mejor).
Hay distintas formas de medir el pH de las sustancias. La más sencilla en  el laboratorio es usar el papel tornasol. Se echa una gotita del líquido en él (o introducimos el papel en el líquido, a gusto del consumidor) y según el color resultante, comparamos con una tabla, y sabemos el valor orientativo de su pH. A este tipo de sustancias que nos permiten conocer el pH de otras se les llama indicadores (normalmente porque cambian de color a un pH determinado). También disponemos de ph-metros electrónicos que dan lecturas de pH mucho más exactas.
el laboratorio es usar el papel tornasol. Se echa una gotita del líquido en él (o introducimos el papel en el líquido, a gusto del consumidor) y según el color resultante, comparamos con una tabla, y sabemos el valor orientativo de su pH. A este tipo de sustancias que nos permiten conocer el pH de otras se les llama indicadores (normalmente porque cambian de color a un pH determinado). También disponemos de ph-metros electrónicos que dan lecturas de pH mucho más exactas.

 Ojo con esto del pH neutro, cuando un producto cosmético anuncia en la televisión que tiene pH neutro, no quiere decir pH 7, sino que tiene el mismo pH que la piel, que es de 5,5. Como veis, la piel es ligeramente ácida. Lo ideal es que el jabón que utilicemos tenga el mismo pH que la piel (cuanto más próximo a 5,5 sea su pH, mejor).
Ojo con esto del pH neutro, cuando un producto cosmético anuncia en la televisión que tiene pH neutro, no quiere decir pH 7, sino que tiene el mismo pH que la piel, que es de 5,5. Como veis, la piel es ligeramente ácida. Lo ideal es que el jabón que utilicemos tenga el mismo pH que la piel (cuanto más próximo a 5,5 sea su pH, mejor). el laboratorio es usar el papel tornasol. Se echa una gotita del líquido en él (o introducimos el papel en el líquido, a gusto del consumidor) y según el color resultante, comparamos con una tabla, y sabemos el valor orientativo de su pH. A este tipo de sustancias que nos permiten conocer el pH de otras se les llama indicadores (normalmente porque cambian de color a un pH determinado). También disponemos de ph-metros electrónicos que dan lecturas de pH mucho más exactas.
el laboratorio es usar el papel tornasol. Se echa una gotita del líquido en él (o introducimos el papel en el líquido, a gusto del consumidor) y según el color resultante, comparamos con una tabla, y sabemos el valor orientativo de su pH. A este tipo de sustancias que nos permiten conocer el pH de otras se les llama indicadores (normalmente porque cambian de color a un pH determinado). También disponemos de ph-metros electrónicos que dan lecturas de pH mucho más exactas.
