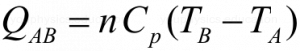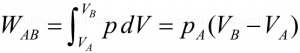La transformación entre los dos estados será isobárica y esta caracterizada por la relación:
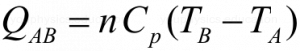
Representa la cantidad de calor necesaria para dar a la masa gaseosa de n moles del gas para llevarla desde TA hasta TB, o sea desde la inferior a la superior.
Cuando el gas se calienta su volumen crece proporcionalmente y la masa gaseosa realiza un trabajo W contra el medio, de acuerdo a :
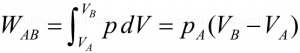
Con estas relaciones podrás resolver el tema. Toma en cuenta que la masa es de 64 gramos o sea 64g / 16 g/mol = 4 moles de Oxigeno.
Tené cuidado con la homogeneidad de las unidades de cada dato.
1) La temperatura final
Utiliza TA/TB = VA/VB ..............................TB = ..............................
2) Presión de la evolución
La presion es constante = nRT/V . La hallas directamente
3) Energía calórica.
La energia termica Q( AB) puesta en juego la hallas aplicando la primer formula que te puse.
4) Trabajo realizado
El trabajo realizado será (+) y lo despejas de la segunda fórmula que te indiqué.
5) Variación de la energía interna
Aquí debes ir al primer principio aplicando:
W = delta U - delta Q
Cualquier duda adicional volvés a consultarnos.