Preguntas esperando respuesta
Actividad pública reciente
Ha respondido en
Microsoft Excel
y en 2 temas más
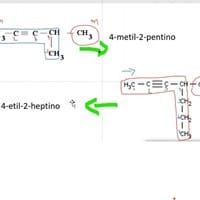
01 formular la imagen y en la 02 nombrar la fórmula.
Ha valorado "Buena" la respuesta
10 litros de una muestra gaseosa se encuentran a una presión de 2 atm y 227 ºC. ¿Qué volumen ocuparía el gas bajo una presión de
Debes usar la ecuación Donde los índices sub1 son los valores iniciales, los sub2 los finales. De aquí despejas V_2 Ten en cuenta que las temperaturas deben ser expresadas en Kelvin
Ha valorado "Excelente" la respuesta
Se tiene una cantidad de 30 moles de un gas ideal que sufre expansión isotérmica. La presión inicial de ésta masa de gas es de
A) Si la transformación es isotérmica te vale: P1V1 = P2V2 .............P2 = 15 X 10 / 45 = .........................Atm. B) Para el primer estado tenes . P1V1 = n RT1.......T1= P1.V1/ n R ..................... = T1 = 15 . 10 / 30 . 0.082 =...
Ha valorado "Excelente" la respuesta
En un proceso isotérmico el volumen de un gas se quintuplica, si la presión inicial es de 20 atm, calcula la presión final.
Siempre plantea PV = nRT Si es proceso isotermico, en la transformacion te vale P1V1 = P2V2 ......... Te dicen que: V2 = 5V1 ...........................P2 = P1 V1/V2 = 20 . V1/5V1 = 4 atm.
Ha valorado "Excelente" la respuesta
4. ¿Cuántos gramos de sulfato de Zinc (ZnSO4) se producirá a partir de 8,5g de Zinc? P.A(S=Zn=65,4; )
Analizas cada molecula gramo de reactantes y productos. Luego haces una simple regla de tres. De la estequiometrica : 65.4 + 98 = m + 2 .........m = 161.4 ......moleculas gramo. Luego: 65.4 g Zinc ... 161.4 gramos de sulfato 8.5 g Zinc ... X gramos...
Ha valorado "Excelente" la respuesta
3. ¿Cuántas moles de agua se forman a partir de 40 g de Hidrógeno gaseoso? P.A (H=1, O=16)
Primero debes balancear la ecuación (es muy sencilla por lo que puede balancearse 'a ojo') Cuando la tengas balanceada verás que la relación estequemétrica entre hidrogeno gaseoso y agua es la misma Luego calculas cuantas moléculas de hidrogeno...
Ha valorado "Excelente" la respuesta
2. Determinar el número de moles de agua que se forman al quemarse 5 moles de metano (CH4)CH4 + O2 --- CO2 + H2O
Stefany, lo primero que debes hacer es balancear la fórmula ya que la misma no está balanceada. A ojo se ve que la fórmula balanceada es: O sea que por cada mol de metano se obtiene 2 moles de agua, por lo tanto para 5 moles de metano obtendrás...?