El fenómeno de corrosión es un proceso de reacción electroquímica de dos elementos conductores en contacto, rodeados o en presencia de elementos ionicamente conductores como lo son p. ej. el agua de mar, la tierra húmeda y la humedad relativa ambiental. Esta reacción se produce tanto más rápidamente cuanto mayor sea la diferencia entre los llamados " potenciales electroquimicos" de ambos elementos en contacto. Por ejemplo .. El acero se corroerá naturalmente en presencia de un electrolito, como ser el agua salada. Si se une eléctricamente una estructura de acero a otro elemento metálico llamado " de sacrificio" (como una aleación de zinc, aleaciones de aluminio o magnesio), teniendo estas sustancias potenciales electroquimicos de reducción más altos... son los que se corroerán primero protegiendo al metal base.
Tamaño relativo de ánodo y cátodo: Esto se conoce como "efecto de la zona". Con la aplicación de una cierta cantidad de corriente a un par metálico, por ejemplo, de electrodos de cobre y de hierro de diferentes tamaños, la densidad de corriente es mucho mayor para el electrodo más pequeño que para el más grande... Como es el ánodo (+) el que se corroe más rápido, cuanto más grande sea el ánodo en relación con el cátodo, menor será la corrosión. Por el contrario, un ánodo pequeño y un cátodo grande hará que el ánodo se dañe rápidamente, y la proteccion se desactive.
La corrosión electroquímica es un proceso espontáneo que denota siempre la existencia de una zona anódica (la que sufre la corrosión), una zona catódica y un electrolito, y es imprescindible la existencia de estos tres elementos, además de una buena unión eléctrica entre ánodos y cátodos, para que este tipo de corrosión pueda tener lugar. La corrosión más frecuente siempre es de naturaleza electroquímica y resulta de la formación sobre la superficie metálica de multitud de zonas anódicas y catódicas; el electrolito es, en caso de no estar sumergido o enterrado el metal, el agua condensada de la atmósfera, en zonas de alta humedad relativa.
Resumiendo;
Todo procedimiento que elimine los ánodos de la superficie metálica haciéndola toda catódica, se conoce con el nombre de protección catódica.
Las formas de tal protección las podes lograr así:
a) Conectando el metal que se trata de proteger a otro menos noble que él, es decir, más negativo en la serie electroquímica. Este sistema se conoce como protección catódica con ánodos galvánicos o de sacrificio y consiste realmente en la creación de una pila galvánica en que el metal a proteger actúe forzosamente de cátodo (polo positivo de la pila), mientras que el metal anódico se "sacrifica", o sea que se disuelve. Como el metal más comúnmente utilizado en la práctica por su bajo precio y alta resistencia mecánica es el acero, los metales que se puedan conectar a él y que deben tener un potencial más negativo quedan reducidos a los tres básicos en la práctica ... zinc (Zn), ... aluminio (Al), ... magnesio (Mg) y a sus aleaciones.
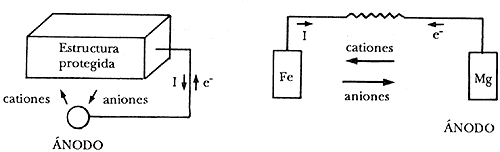
Protección catódica con ánodos galvánicos o de sacrificio.
b) Conectando el metal a proteger al polo negativo de una fuente de alimentación de corriente continua, pura o rectificada, y el polo positivo a un electrodo auxiliar que puede estar constituido por chatarra de hierro, ferro-silicio, plomo-plata, grafito, etc. Este sistema se conoce con el nombre de protección catódica con corriente impresa.
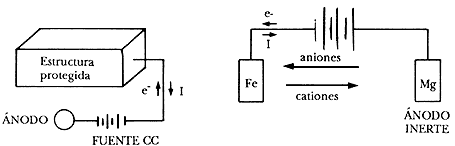
Protección catódica con corriente impresa.
Este método de resguardo catódico se emplea en estructuras grandes o extensas donde los ánodos galvánicos no pueden suministrar suficiente protección. El sistema, que requiere una fuente de tensión c.c. para polarizar inversamente y neutralizar los efectos corrosivos es de obligada utilización en la protección catodica de tuberías de acero enterradas ( Gas a presión, petroleo, etc.).



