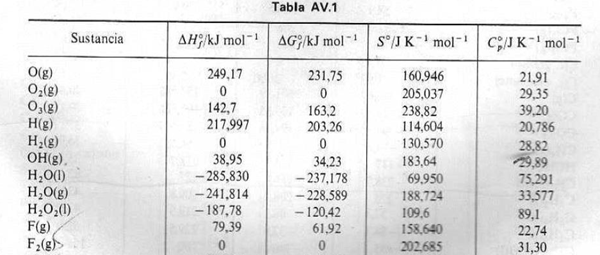
El dato de la entalpía de formación del agua (líq) es erróneo. La entalpía de formación del agua (líq) es -285,8 KJ/mol. Si quieres, hazlo con el dato tal como te lo dan, pero, con ese dato, para hervir agua no sólo no habría que calentarla sino que se liberaría calor en el proceso.
a)
H2O(líq) ---> H2O(gas) …………… Delta H(vaporización)
Delta H(vaporización) = DeltaHf(gas) – DeltaHf(líq)
Delta H = -241,814 – (-285,8) = 44,0 KJ/mol
b)
Comparemos el volumen de 1 mol de agua líquida (0,018 L) con el volumen de 1 mol de agua gas (aproximadamente 22,4 L en c. n.). Como es más de 1000 veces menor, podremos despreciarlo cuando lo comparemos con el volumen en fase gas.
De todas formas, podríamos calcularlo así:
Siendo la densidad del agua a 25 ºC 0,997 g/cm^3, el volumen que ocupa 1 mol (18 g) es
V(líq) = m / d = 18 g / (0,997 g/cm^3) = 18,05 mL = 0,01805 L
Calculemos ahora el volumen que ocupa 1 mol de agua en fase gas a 1 atm y 25 ºC:
P V = n R T
1·V(gas) = 1·0,082·298
V(gas) = 24,4360 L
Como se ve, V(gas) – V(líq) = 24,4360 – 0,01805 = 24,4180, que es prácticamente igual al volumen en fase gas.
El trabajo a presión constante vale
W = - p·DeltaV = - p·(Vgas – Vlíq)
Para 1 mol, y usando el S.I. para que el trabajo quede en joules,
W = -1·101300·(22,4360 – 0,01805)·10^(-3) = -2270 J/mol = -2,27 KJ/mol
Con el redondeo, hubiéramos llegado exactamente al mismo resultado despreciando el V(líq).
c)
DeltaE = Q + W = 44,0 – 2,27 = 41,73 KJ/mol