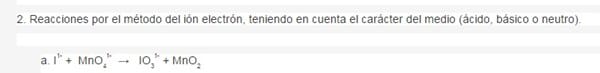
Oxidante: MnO4(-). El Mn cambia su número de oxidación desde +7 en el MnO4(-) hasta +4 en el MnO2 (se reduce)
Reductor: el I(-). El I cambia su número de oxidación desde -1 en el ion I(-) hasta +5 en el ion IO3(-) (se oxida)
En medio básico el permanganato se reduce a MnO2.
Semirreacción de reducción: se reduce el MnO4(-)
MnO4(-) + 2 H2O + 3 e(-) --------> MnO2 + 4 OH(-)
Semirreacción de oxidación: se oxida el I(-)
I(-) + 6 OH(-) --------> IO3(-) + 3 H2O + 6 e(-)
Multiplicando la primera por 2 y sumando, queda
2 MnO4(-) + I(-) + H2O ------------> 2 MnO2 + IO3(-) + 2 OH(-)
La reacción queda ajustada.
Para ver en detalle cómo se ajustan estas reacciones, mira aquí:
http://www.todoexpertos.com/preguntas/6ujygkhcli9cf8g6/como-balanceo-esta-ecuacion-quimica?selectedanswerid=6ukhf7lddsewegdu&nid=f8qabuuhg8qptrefgkqmngkt9stppvma9gsphfuri8pq9ssmhjw65