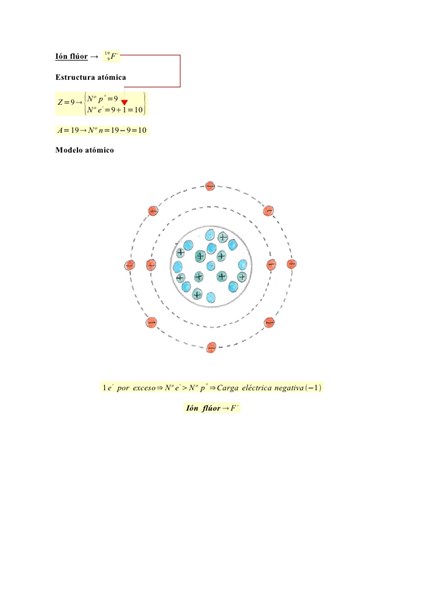
Perdona por haber tardado un poco.
La verdad es que esta pregunta es bastante sencilla y deduzco que debe de corresponderse a primeros años de bachillerato. Supongo que la respuesta debes de tenerla en tu libro de texto, apuntes de clase y tu profesor (si es un buen profesor) en clase haber explicado estas cosas. Pero te voy a responder.
Los aniones N3-, O2-, F- y los cationes Na+ y Mg2+ lo que tienen en común es su configuración electrónica, es decir que todos ellos tienen el mismo número de electrones con la misma disposición en sus niveles de energía, es decir, que electrónicamente hablando son idénticos con los mismos electrones de valencia.
El átomo de Nitrógeno elemental tiene 7 electrones con la siguiente configuración 1s22s22p3. El anión N3- ha ganado 3 electrones de más y su configuración es entonces 1s22s22p6, es decir ha pasado de tener 7e- (electrones) a tener 10. En el caso del Oxígeno hay 8 electrones. Supongo que te habrán explicado y sabrás que el número de electrones de un elemento químico viene determinado por su número de posición en la tabla periódica! El oxígeno es el elemento número 8 luego tiene 8 electrones y así sucesivamente! El anión O2- ha ganado 2e- más y ha pasado a tener 10 en total. Luego la configuración ha pasado de ser 1s22s22p4 a ser 1s22s22p6. Lo mismo para el anión flúor F-, el flúor elemental tiene 9e- y ese anión otros 10e-, luego la configuración ha pasado de 1s22s22p5 a 1s22s22p6. Para los cationes exactamente lo mismo, pero en vez de ganancia de electrones lo que hay es perdida de electrones. El sodio Na elemental tiene 11e-, luego tiene una configuración de 1s22s22p63s1 y al perder 1 electrón pasa a la misma configuración de los otros iones, 1s22s22p6. Para el Mg2+ la pérdida ha sido de 2e- con respecto al átomo elemental, se ha pasado de 1s22s22p63s2 a 1s22s22p6.
Luego queda bien claro que lo que tienen en común esos iones es su número de electrones, su configuración y disposición de electrones en los orbitales que ese es el diagrama que a continuación te piden.
La cosa es muy sencilla y es cuestión de ir llenando los orbitales, cada uno con 2 electrones como máximo, un electrón con spín positivo (flecha hacia arriba) y otro electrón con spín negativo (flecha hacia abajo). En un mismo orbital NO puede haber más de 2 electrones, y esos 2 uno está hacia arriba y otro hacia abajo. El orden de llenado es siempre empezar por el nivel de mejor energía y subiendo hacia el de mayor energía. En niveles avanzados de química te explicarán que el orbital S es el más sencillo y es de forma esférica. Un orbital es la zona de máxima probabilidad de encontrar al electrón en el espacio y eso es el resultado de resolver la ecuación de Schroedinger. El nivel energético P tiene 3 orbitales, el Px, el Py y el Pz orientados a los largo de los ejes X, Y y Z. Los orbitales P tienen forma de 2 lóbulos unidos. Luego los orbitales P son 3 orbitales en el que cada uno caben 2 electrones (al igual que en los S y en todo orbital) y al ser 3, 3x2=6, luego en un nivel P como máximo pueden haber 6 electrones.
Luego para dibujar el esquema empiezas por abajo y pones 1s y al lado una raya donde encima de ella representas los 2e-, una flecha hacia arriba y otra hacia abajo. Arriba del 1s, pones el 2s (arriba pues estás subiendo de energía) y pones otra raya con sus 2 flechas. Encima del 2s pones el nivel 2p y pones 3 rayas (horizontales una al lado de la otra pues estás en el mismo nivel energético, el 2p) que representan al orbital 2px, 2py y 2pz. Los electrones son como las personas, no nos gustan que nos molesten y si en una casa hay 3 habitaciones y 3 personas, esas 3 personas cada una se va a una habitación diferente. Pero si 4 personas y sólo 3 habitaciones sin más remedio se formará una pareja y en una habrá 2 personas y en las otras 2 sólo una persona! Jaja Pues bien, para el N en el 1s ya hay 2 electrones, en el 2s otros 2 electrones y nos quedan por colocar 3e- que cada uno se irá a un orbital 2p diferente. En el 2px pones una flecha, en el 2py otra y en el 2pz otra. Para el anión N3- hay que agregar 3 electrones más. Los niveles 1s y 2s ya están ocupados llenos luego te subes al 2p donde en cada uno de esos 3 orbitales ocupados por un solo electrón puedes añadir en cada uno uno de los 3 nuevos electrones y así nos quedan 3 orbitales p llenos con su pareja de electrones o 2 flechas (arriba y abajo) en cada uno. Y este es el diagrama que se te pide.
Otro ejemplo más. En el F, pones el nivel 1s con sus 2 fechas o electrones, arriba el 2s con otros 2 electrones y ahora hay que colocar 5 electrones. Empiezas poniendo una flecha en el 2px, luego en el 2py, luego el 2pz, luego otro más en el 2px y el último en el 2px. Para el anión F- tenemos que añadir un solo nuevo electrón que solamente puede ir al 2pz donde hay un hueco libre.
Para los cationes, lo mismo pero en vez de añadir electrones simplemente hay que quitar. Por ejemplo el Mg2+ pintas el nivel 1s con sus 2 flechas, arriba el 2s con sus 2 flechas (electrones, recuerda), arriba el 2p con sus 3 orbitales llenos cada uno con 2 flechas y arriba del todo el nivel 3s con sus 2 electrones. Pues bien, al quitar 2 electrones se quitan los más externos, los de valencia que son esos 2 que están en el nivel 3s2 y al quitar estos nos queda exactamente la misma disposición que para los otros ejemplos de 10 electrones con todos los orbitales ocupados.
Bueno la siguiente pregunta que pide te la dejo para ti, tienes que saber que todos tienen 10 electrones y lo que los diferencia entonces son su diferente número de protones y neutrones y ya el saber cuál es más grande eso ya es elemental jajaja
Bueno espero haberte ilustrado el asunto y aclarado la duda. En realidad todo esto es muy divertido el ir dibujando los niveles y llenándolos con las flechitas o electrones jaja
Salu2!
![]()